| 일 | 월 | 화 | 수 | 목 | 금 | 토 |
|---|---|---|---|---|---|---|
| 1 | ||||||
| 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 23 | 24 | 25 | 26 | 27 | 28 | 29 |
| 30 |
- 포스코공채
- Python
- ppt
- 돌출
- 연료전지
- 로고 고정
- 이미지모듈
- 사용자 지정 레이아웃
- pt면접
- Fusion 360
- PEMFC
- 파이썬
- CAD
- SOFC
- 파워포인트
- 포스코
- 아나콘다
- 스틸브릿지
- 모깎이
- 모듈
- 포스코인턴
- 자기소개서
- EXTRUDE
- github
- image 모듈
- 열역학
- 로프트
- Fuel Cell
- 취준일기
- git
- Today
- Total
신군의 역학사전
[연료전지개론] 연료전지 종류 (Overview Of Fuel Cell Types) 본문
[연료전지개론] 연료전지 종류 (Overview Of Fuel Cell Types)
긔눈 2024. 1. 11. 12:00
연료전지는 주로 사용하는 전해질에 따라 그 종류가 결정됩니다. 따라서 다양한 종류의 연료전지의 이름은 대부분 사용되는 전해질에 대한 정보를 담고 있습니다. 흔히들 가장 많이 사용되고 또 많은 연구가 진행되어온 5가지의 연료전지를 주로 Major한 Type의 연료전지라 하는데요, 이는 아래의 5가지가 있습니다.
1. PAFC (Phosphoric Acid Fuel Cell)
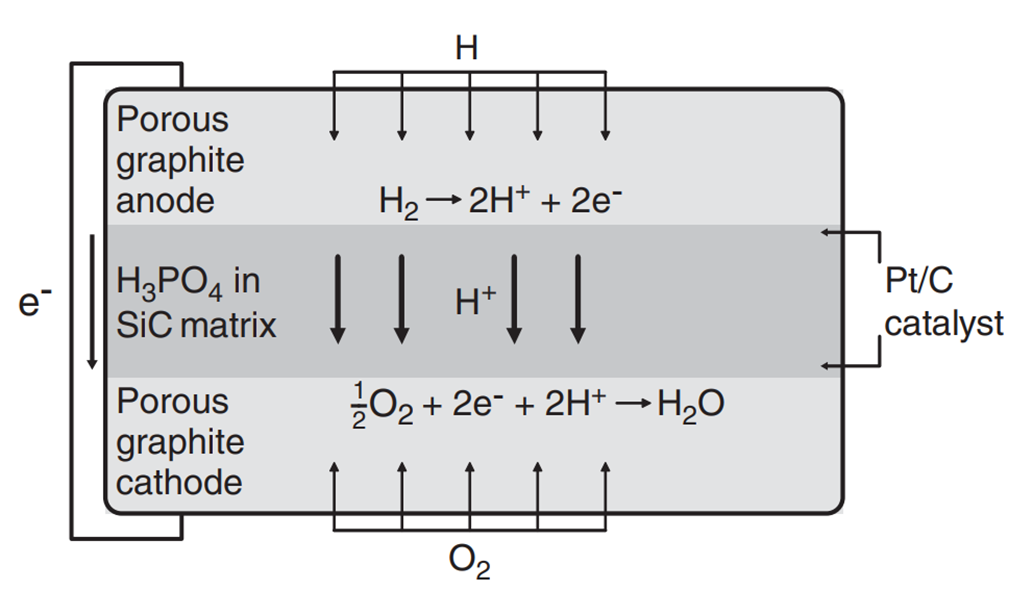
인산형 연료전지(PAFC)는 말 그대로, 전해질로 액체 인산(H3PO4)을 사용한 연료전지를 말합니다. 전해질의 기계적 강도를 높이고 전극을 분리하며 Gas Crossover를 최소화하기 위해 SiC matrix에 액체 인산이 삽입된 형태로 전해질이 구성됩니다. Anode쪽에 연료인 수소가, Cathode쪽에는 산화제인 산소가 공급이 되며, 수소 이온이 전해질을 통과하여 캐리어의 역할을 수행합니다. 전극 별 반응식은 아래와 같습니다.
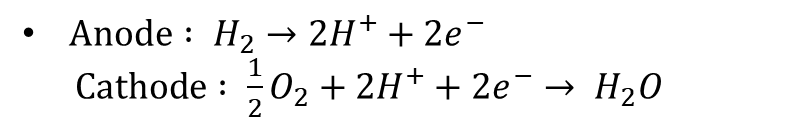
인산의 녹는점은 섭씨 42도 정도로, 이하의 온도에서는 응고가 일어나므로 42도 이상의 온도에서 연료전지가 작동되어야 합니다. 최적온도는 180~210도 정도로 알려져 있습니다. 210도 이상의 고온에서는 상전이에 의한 성능감소가 발생할 수 있으므로, 최적온도 구간을 잘 유지하는게 중요합니다.
PAFC의 전기 효율은 Unit단위 기준 40%, 폐열을 함께 활용할 경우 70%에 달하는 것으로 알려져 있습니다. 높은 에너지 효율과 함께 전지의 신뢰도(Reliability)가 높고 전해질의 가격이 싸다는 장점이 있습니다. 하지만 Pt계열의 촉매가 활용되어, 촉매 가격이 비싸며, 고온 작동 환경에선 액체 인산이 지속적으로 증발되기 때문에, 지속적인 전해질의 충전이 필요하다는 단점 역시 있습니다. 또한 Pt계열의 촉매를 활용하므로, CO에 대한 피독에 취약하다는 점도 단점으로 꼽을 수 있습니다. 물론 이 경우 순수한 수소와 산소를 사용했을 때 발생하는 문제는 아니고, 탄소가 포함된 개질 연료, 산화제를 사용할 때 발생할 수 있는 문제점입니다.
2. PEMFC (Polymer Electrolyte Membrane Fuel Cell)
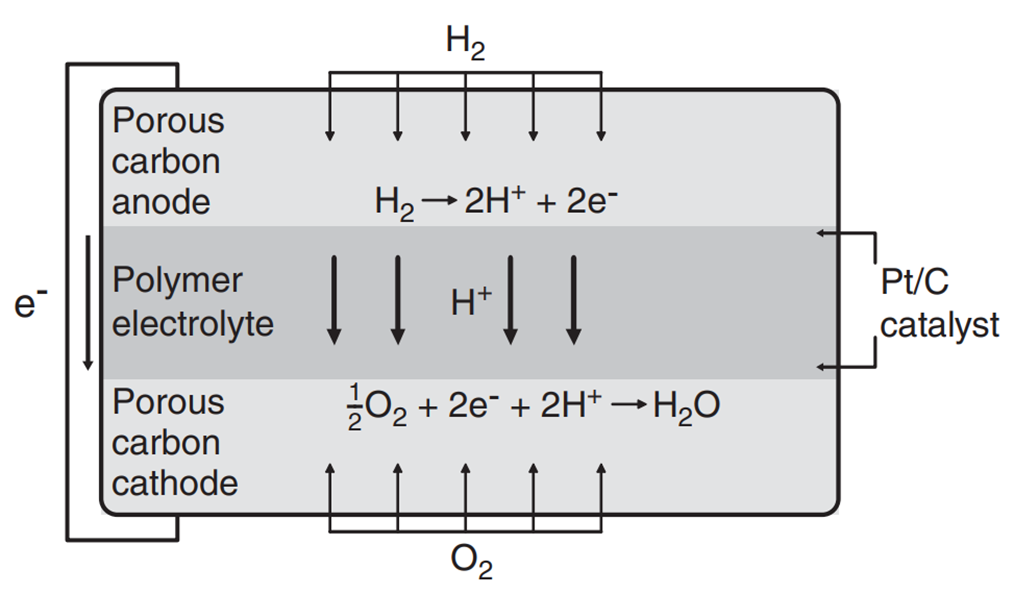
PEMFC는 고분자 전해질 연료전지(Polymer Electrolyte Membrane Fuel Cell) 혹은 양성자 교환 막 연료전지(Proton Exchange Membrane Fuel Cell)로 불립니다. 폴리머 계열의 전해질을 사용하며 PAFC와 마찬가지로 수소 이온이 캐리어의 역할을 합니다. 따라서 전극 반응식 역시 PAFC와 동일합니다. 주로 나피온(Nafion)과 같은 과불화술폰산(Perfluorinated Sulfonic Acid) 폴리머가 사용됩니다.
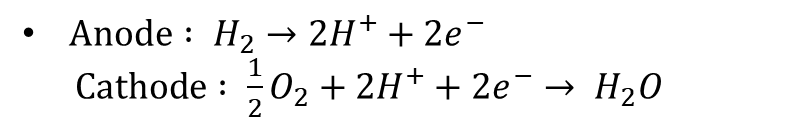
폴리머 막의 경우 일정수준 이상의 전기 전도성을 유지하기 위해서는 적절히 수화되어야 합니다. 이러한 점 때문에 PEMFC의 작동은 물의 끓는점보다 낮은 온도에서 이루어져야 합니다. 주로 온도 상한선은 섭씨 90도 정도로, 최적 작동온도는 60~80도 정도로 알려져 있습니다.
낮은 작동온도로 인해 자동차와 같은 Portable한 시스템의 적용에 유리하다는 장점이 있습니다. Start - Stop Capability가 좋아 실제로 현재 시판 중인 수소 연료전지 자동차(FCEV)인 넥쏘(NEXO)에는 바로 이 PEMFC가 탑재되고 있죠. 하지만, 낮은 작동온도로 인해 Platinum 계열의 촉매 사용이 강제되며, Pt 계열 촉매의 경우 가격이 비싼편이고, CO와 S에 대한 피독(Poisoning)에 취약하다는 문제가 있습니다.
하지만, PEMFC는 주요 연료전지들 중 가장 높은 출력밀도(Power Density)를 보이고 있고, Portable 디바이스에의 적용이 가장 쉽다는 장점 덕분에 가장 많은 부분 상용화를 이루어 왔습니다.
3. AFC (Alkaline Fuel Cell)
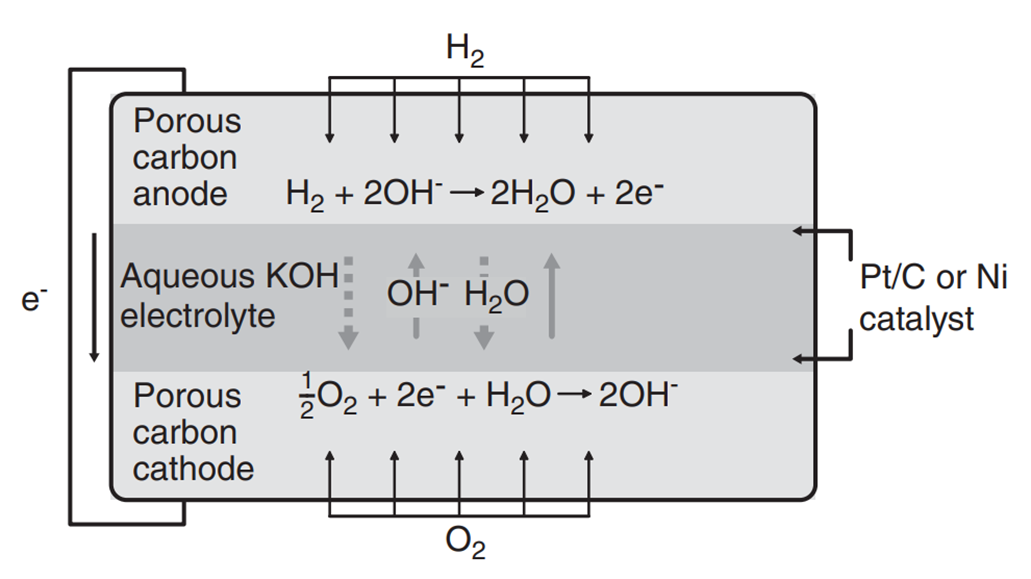
알칼리 연료전지(AFC)는 수산화 칼륨 수용액(aqueous potassium hydroxide)을 전해질로 사용한 연료전지를 말합니다. 수소 이온이 전해질을 통과하는 산성 연료전지(PAFC, PEMFC 등)와는 다르게, 수산화이온이 캐리어의 역할을 하게 됩니다. 이온의 이동 또한 Cathode에서 Anode 방향으로 일어납니다.
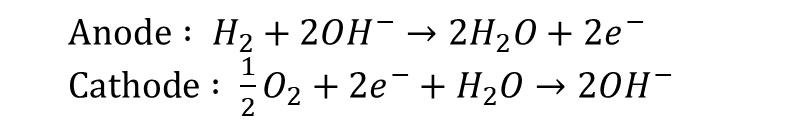
Anode반응에서 물이 생성되고, 이때 생성된 물이 전해질을 통과하여 Cathode 반응에 사용이 됩니다. 이때 Anode쪽에서 발생한 물이 과도하게 쌓일 경우, 전해액을 희석시켜 연료전지의 성능감소를 유발할 수 있어, 적절한 물 제거가 필요합니다. 또한 AFC는 연료와 산화제로 순수한 수소와 산소만을 사용해야하는데요, 이산화탄소가 전해액인 KOH과 수산화 이온과 결합하여 전해액의 성능감소를 유발하기 때문입니다. 이는 아래의 반응식을 따릅니다.
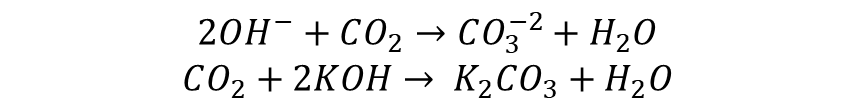
이렇게만 보면 단점만 있을 것 같지만, 반대로 AFC만의 차별화된 장점 역시 있습니다. AFC는 알칼리 환경에서 작동하기 때문에, Pt계열 이외의 Metal-Based의 촉매를 사용할 수 있으며, 이부분에서 비용절감 효과를 가져올 수 있습니다. 연료전지의 상용화를 막는 가장 큰 걸림돌이 가격문제인 점을 생각해본다면, 이는 굉장히 큰 장점이 될 수 있습니다. 실제로 니켈과 같은 금속들이 AFC에 사용되고 있죠. 또한 알칼리 환경에서 활성과전압이 산성환경에 비해 낮고, 산소환원반응(ORR)이 빠르게 일어나기 때문에 성능 면에서 차별화된 장점이 있습니다. 이런 장점들을 살려 아폴로 미션에 AFC가 사용되기도 하였습니다.
또한 AFC의 작동온도는 60~250도 정도로 알려져 있습니다.
4. MCFC (Molten Carbonate Fuel Cell)
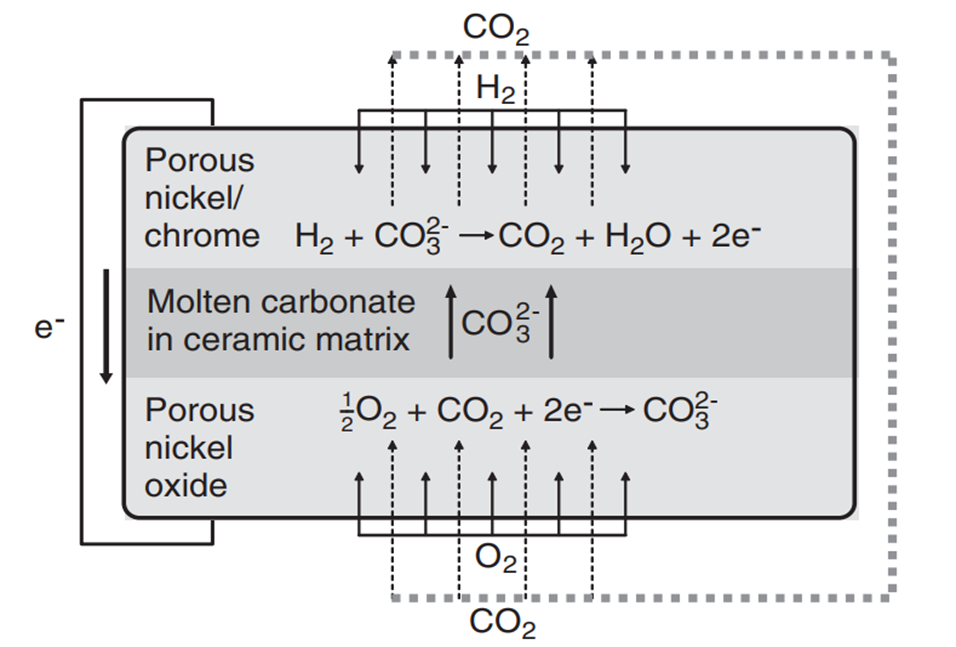
용융 탄산염 연료전지(MCFC)는 전해질로 알칼리 탄산염이 사용된 연료전지를 말합니다. 주로 Li2CO3, K2CO3와 같은 물질이 LiO-AlO2 Matrix에 고정된 형태로 전해질이 구성됩니다. AFC와 마찬가지로 알칼리 환경에서 구동되기 때문에 Cathode에서 Anode쪽으로 이온 전도가 일어나며, 탄산 이온이 전하 캐리어의 역할을 수행합니다. 또한 Pt계열이 아닌 다른 Metal-Based 촉매를 활용할 수 있습니다. AFC와 공유하는 장점입니다.
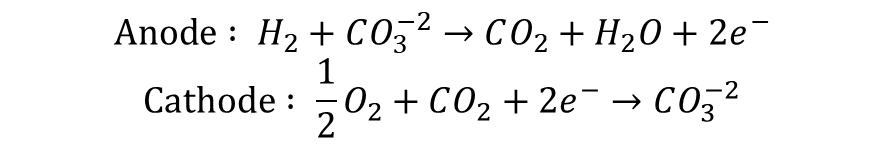
MCFC는 Anode 반응에서 CO2가 생성되고 Cathode 반응에 이를 소비합니다. 따라서 별도의 CO2 Cycling 과정이 필요합니다. Anode 반응에 사용되고 남은 Waste Steam들을 버너로 보내 외부 공기와 함께 가열하여 Cathode쪽에 재공급하는 방식으로 CO2 Cycling을 시켜주는데요, 산화제(산소)의 예열을 통해 작동 효율과 온도를 높일 수 있다는 장점이 있습니다. MCFC의 작동온도는 650도 정도로, 고온에서 작동하기 때문에 폐열을 활용한 Cogeneration을 통해 전제 시스템 효율을 90%가까이 올릴 수 있습니다. Unit Cell의 효율이 50%정도인 점을 미루어볼 때, 폐열 활용도가 굉장히 높다고 할수 있죠. 하지만 별도의 Cycling 설비가 필요한 점은 단점으로 다가올 수도 있겠네요.
5. Solid Oxide Fuel Cell (SOFC)
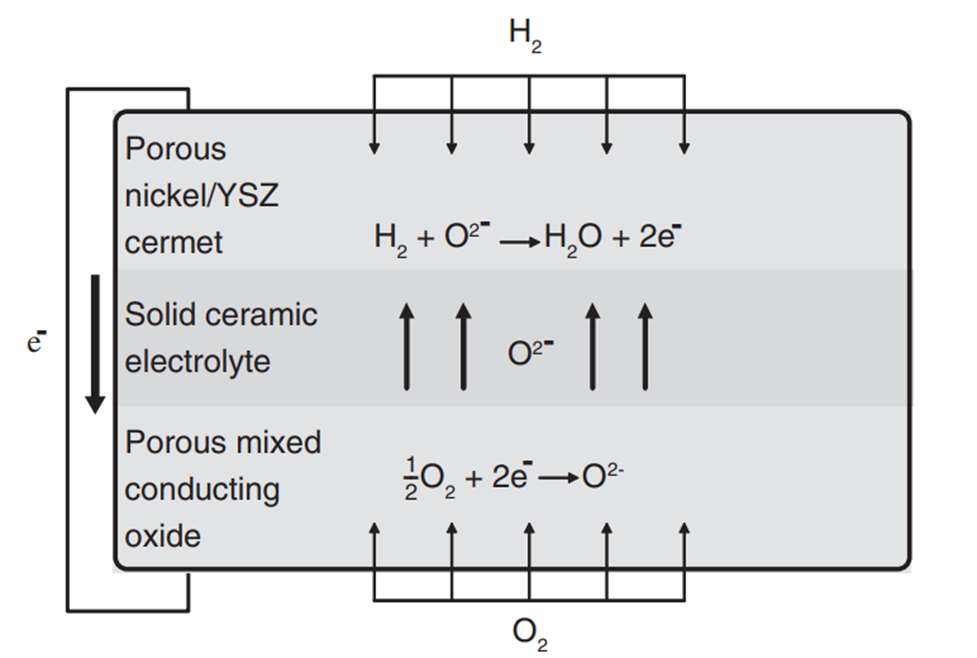
고체산화물 연료전지(SOFC)는 YSZ(Yttria-Stabilized Zirconia)와 같은 세라믹 계열의 물질을 전해질로 사용한 연료전지를 말합니다. SOFC에서는 산소 이온이 전하 캐리어의 역할을 수행하며, Cathode에서 Anode쪽으로 이동합니다.
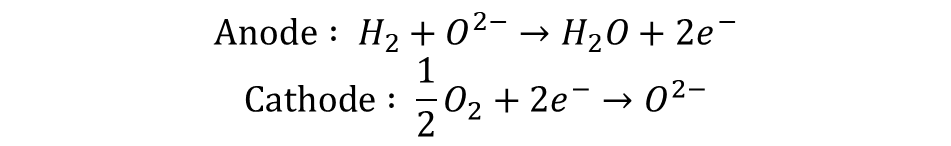
SOFC의 작동온도는 600~1000도 정도로 굉장히 높은데요, 이는 산소 이온의 전도도가 고온에서 높기 때문에 전해질 성능을 높이기 위함입니다. 고온의 작동온도 덕분에 폐열을 활용한 Cogeneration이 가능하여, 시스템 효율을 90%가까이 높일 수 있다는 장점이 있습니다.
SOFC의 가장 두드러지는 특징은 Anode와 Cathode에 다른 물질을 썼다는 점인데요, Anode에는 Nickel-YSZ cermet을, Cathode에는 LSM, LSF, LSC, LSCF와 같은 세라믹 계열의 재료를 사용합니다. Pt 계열의 촉매는 높은 촉매 활성도를 보이긴 하지만, SOFC의 고온환경에서는 Agglomeration이 발생하므로, 좀더 열적으로 안정한 Nickel-Based 촉매를 활용합니다. 니켈의 경우 이온 전도성과 촉매활성을 높여주고, YSZ의 경우 이온 전도성과 Porosity를 높게 해주는 장점이 있어 Anode에는 니켈이 활용되지만, 산소가 공급되는 Cathode 에서는 산화반응이 일어나 전극의 열화를 일으키므로 니켈 전극을 사용하지 않습니다.
또한 SOFC는 모든 Component들이 고체로 되어있어 Sealing Issue가 있으며, 고온의 작동온도로 인해 Start - Stop Capability가 좋지 않다는 단점 역시 있습니다.
[Reference]
O'HAYRE, Ryan, et al. Fuel cell fundamentals. John Wiley & Sons, 2016.
'Fuel Cell > Fuel Cell Engineering' 카테고리의 다른 글
| [연료전지개론] 연료전지 소개 (Introduction for Fuel Cell) (2) | 2024.01.04 |
|---|

