| 일 | 월 | 화 | 수 | 목 | 금 | 토 |
|---|---|---|---|---|---|---|
| 1 | ||||||
| 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 23 | 24 | 25 | 26 | 27 | 28 | 29 |
| 30 |
- Python
- 사용자 지정 레이아웃
- 스틸브릿지
- Fusion 360
- 파워포인트
- 모깎이
- 이미지모듈
- 파이썬
- PEMFC
- github
- 취준일기
- 아나콘다
- 포스코공채
- 로프트
- pt면접
- 모듈
- 포스코인턴
- 로고 고정
- 열역학
- EXTRUDE
- Fuel Cell
- 연료전지
- git
- 돌출
- SOFC
- 자기소개서
- ppt
- 포스코
- CAD
- image 모듈
- Today
- Total
신군의 역학사전
[연료전지개론] 연료전지 소개 (Introduction for Fuel Cell) 본문
1. 연료전지(Fuel Cell)란?
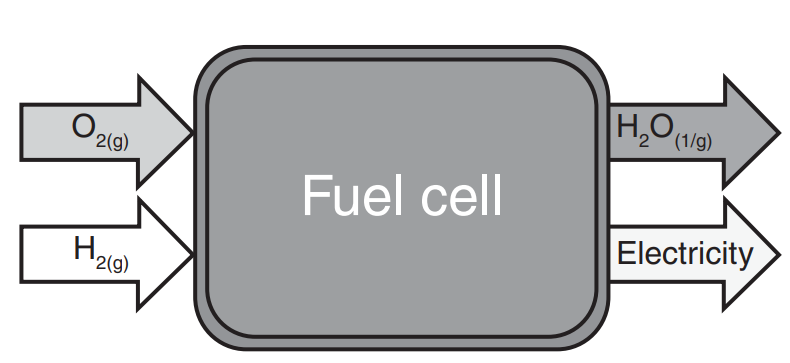
연료전지(Fuel Cell)란 연료(Fuel)와 산화제(Oxidant)의 전기화학적 반응을 통하여 전기에너지를 생산해내는 일종의 발전기를 칭합니다. 지속적으로 공급되는 연료의 화학에너지를 전기에너지로 변환하여 일을 할 수 있도록 해주는 장치를 연료전지라고 하는 거죠. 연료전지의 연료로는 다양한 물질이 사용될 수 있지만, 최근 대두된 환경문제의 해결을 위하여 수소와 같이 탄소배출이 없는 친환경 물질들이 주로 연료로 활용되고 있어, 연료전지라 함은 주로 수소 연료 전지를 칭하는 용어가 되었습니다. 따라서 주로 수소가 연료로, 산소가 산화제로 활용되곤 합니다.
2. 연료전지의 작동원리 & 구조 (Fuel Cell Operation & Structure)
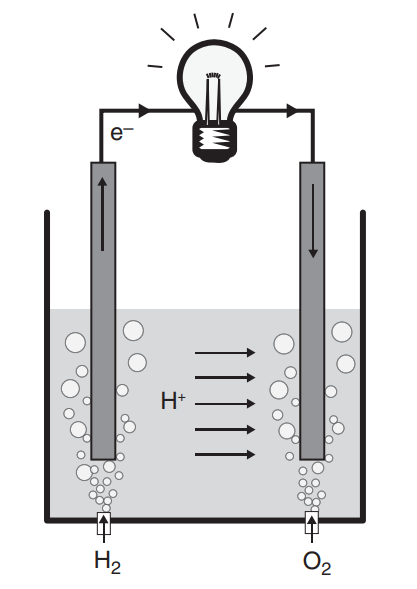
위 그림은 가장 간단한 구조의 연료전지를 나타낸 모식도입니다. 수소의 산화반응은 아래의 관계식에 따르는데요
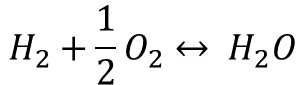
전체 산화반응을 아래의 2개의 반응으로 쪼개어 이루어지도록 구성한 것이 바로 연료전지 입니다.
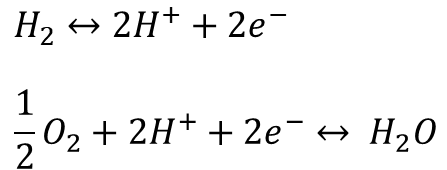
2개의 전기화학반응이 구분되어 일어날 수 있는 이유는 바로 전해질(Electrolyte)때문인데요, 전해질은 이온만 통과시키고 전자는 통과시키지 않기 때문에, 원자 혹은 분자에서 분리된 전자를 외부회로를 통해 이동시키며 일을 할 수 있게 해줍니다. 따라서 전해질을 통해 분리된 2개의 극에서 각각의 반응이 독립적으로 일어날 수 있는 것이죠.
양극(Anode)에서는 수소 원자가 이온화되며 전자가 떨어져 나오며, 이온은 전해질을 통해, 전자는 외부 회로를 통해 이동하며 일을 하고, 음극(Cathode)쪽에서 산소와 결합하는 형태로 반응이 진행됩니다.
산화반응(Oxidation)은 산소와의 결합 / 수소와의 분리 / 전자 잃음 (전자수 감소)
환원반응(Reduction)은 산소와의 분리 / 수소와의 결합 / 전자 얻음 (전자수 증가) 를 수반하므로
양극(Anode)을 산화극, 음극(Cathode)를 환원극으로 칭하기도 합니다.
다만 사용하는 전해질의 종류에 따라, 전해질을 통과하는 이온의 종류는 다를 수 있으며, 이에 해당하는 내용은 차후 정리하도록 하겠습니다.
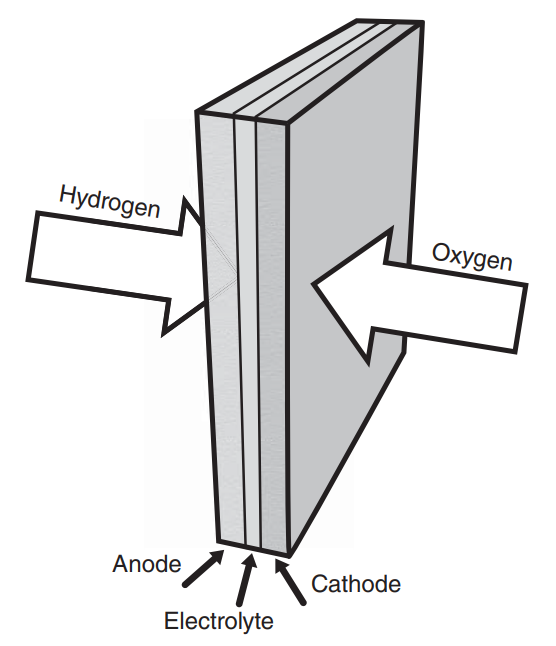
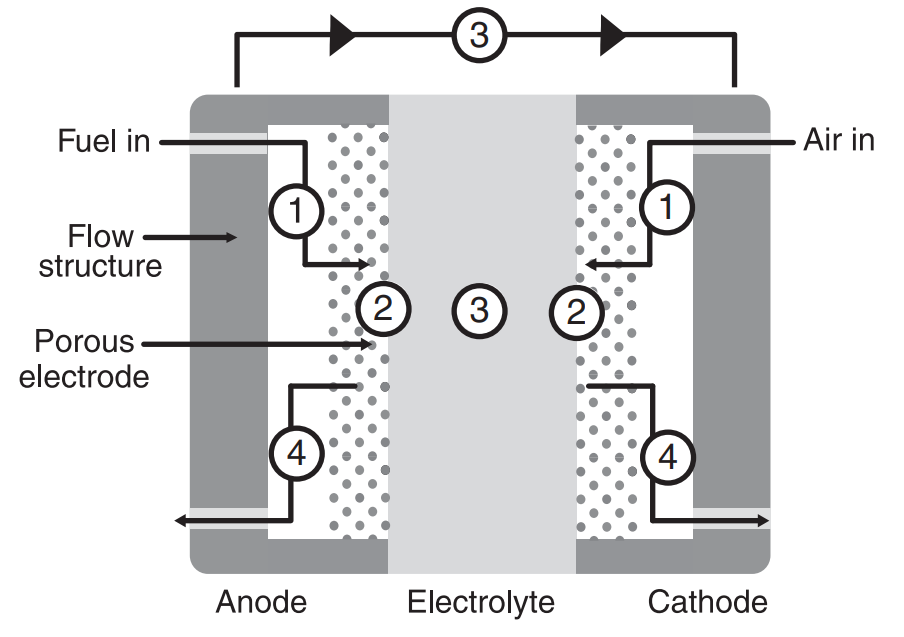
따라서 위 모식도를 좀 더 실제 구조에 유사하게끔 가시화하면 왼쪽 그림과 같으며, 단면 모습은 오른쪽 그림과 같습니다. (1)을 통해 반응물(Reactant)의 공급이 이루어지며, (2)~(3)의 전기화학반응을 통해 생성된 생성물(Product)들이 (4)를 통해 배출되는 과정을 표현하고 있습니다.
특히 위 그림에 표현된 양극-전해질-음극의 구조를 셀(Cell)이라 부르며, 더 높은 출력을 위해 다수의 셀들을 직렬연결한 스택(Stack)단위로 주로 운용 하게 됩니다.
3. 연료전지의 장단점
3-1) 장점 (Advantages)
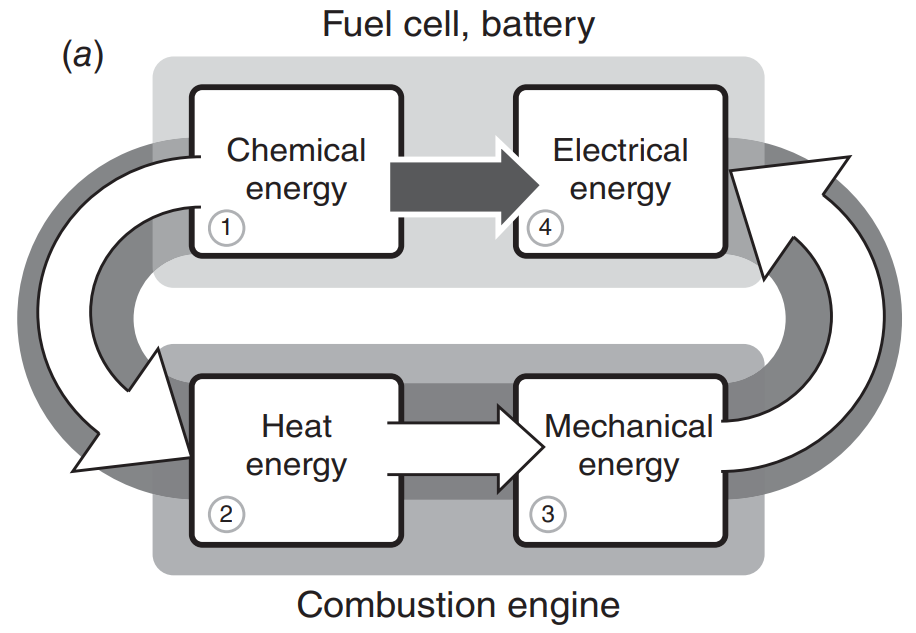
연료전지의 가장 큰 장점으로는 높은 에너지 효율을 꼽을 수 있습니다. 기존의 내연기관 엔진이 화석연료의 화학에너지를 활용하기 위해 여러 단계의 Step Process를 거쳤던 것에 비해, 연료의 화학에너지를 전기에너지로 직접 전환할 수 있기 때문에 에너지 손실이 적습니다. 또한 배터리의 경우 용량을 늘리기 위해선 셀의 수를 늘려야하는데, 이는 곧 시스템의 무게 증가로 이어져 더 많은 전력을 요구하게 되므로 항상 Trade-Off를 고려해주어야 하지만, 연료전지의 경우 단순히 수소탱크만 더 달아주면 되므로, 이런 부분에서 차별화된 장점이 있습니다. 추가로, 연료전지의 모든 부분을 Solid State로 만들 수 있어 안정적이고 조용한 운용이 가능하며, 질소산화물, 황산화물과 같은 공해물질을 배출하지 않는다는 장점 역시 존재합니다.
3-2) 단점 (Disadvantages)
하지만 여러 단점들 역시 존재하는데요, 가장 큰 단점은 역시 가격입니다. 수소 연료전지 자동차인 넥쏘에는 PEMFC가 탑재되는데요, PEMFC의 경우 Pt계열의 촉매가 사용이 되고, 이게 굉장히 비쌉니다... Pt계열의 촉매에 필적하는 반응율을 보이는 새로운 촉매에 대한 연구가 진행되고 있긴하지만, 아직은 여전히 Pt계열 촉매의 사용이 강제되는 것으로 알고 있습니다. 따라서 Pt의 양을 줄이기 위해 카본 담지체에 Pt를 씌운 형태인 Pt/C 촉매가 사용되기도 합니다. 그외에도 내연기관 혹은 리튬이온배터리에 비해 낮은 Power Density를 보이며, 연료의 접근성, 저장성이 떨어진다는 단점들 역시 존재합니다.
4. 연료전지 성능 (Fuel Cell Performance)
연료전지의 성능 곡선은 주로 전류-전압 곡선(I-V Curve)로 표현됩니다. 아래의 그래프는 연료전지의 한 종류인 PEMFC에서 나타나는 I-V Curve인데요, 당연하게도 넓은 면적의 셀에서 더 많은 에너지가 생산되기 때문에, X-axis의 경우 전류 밀도(Current Density)를 사용합니다.
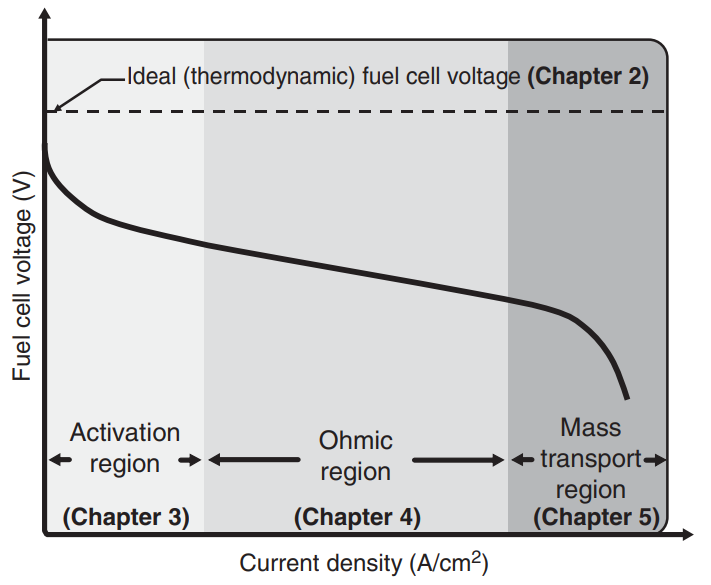
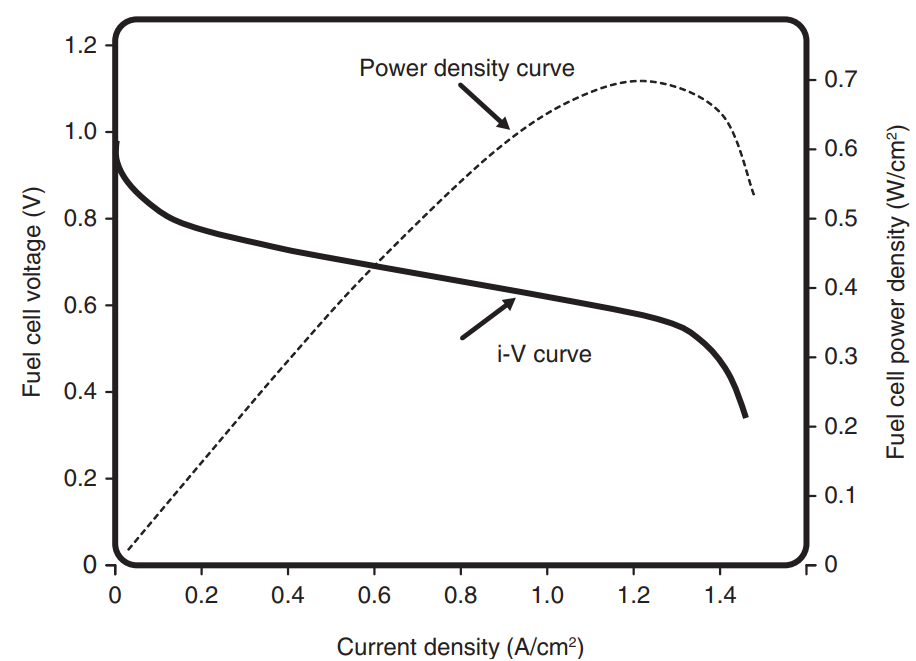
이상적인 조건에서의 출력전압은 위 그래프의 점선과 같이 일정한 값이 도출되지만, 실제 연료전지의 운용에는 여러 비가역적인 전압손실이 발생하여 I-V Curve가 아래의 실선과 같이 나타나게 됩니다.
비가역적 전압손실에는 크게 Activation Loss / Ohmic Loss / Concetraion Loss 의 3가지 요인이 있는데요, 이는 차후 단원에서 자세히 다루어 후속 포스팅을 통해 정리해보도록 하겠습니다. 당장은 연료전지의 I-V Curve 개형은 비선형적으로 감소하는 형태를 보인다~ 정도로만 알고 넘어가도 좋을 것 같습니다.
[Reference]
O'HAYRE, Ryan, et al. Fuel cell fundamentals. John Wiley & Sons, 2016.
'Fuel Cell > Fuel Cell Engineering' 카테고리의 다른 글
| [연료전지개론] 연료전지 종류 (Overview Of Fuel Cell Types) (0) | 2024.01.11 |
|---|

